工作动态
近日,中国科学院武汉病毒研究所抗病毒研究中心邓增钦团队在非洲猪瘟病毒拓扑异构酶的结构解析和催化机制研究中取得进展,相关研究成果以“Cryo-EM structures of African swine fever virus topoisomerase”为题发表在国际学术期刊mBio上。
DNA复制、重组和染色体分离等重要生物过程中都会导致DNA缠绕,即DNA拓扑结构问题,如果该问题得不到解决,将会造成基因组的不稳定,从而降低细胞的生存能力。DNA拓扑异构酶广泛存在于古菌、原核生物、真核生物和一些核质大DNA病毒中,其中Ⅱ型拓扑异构酶可在DNA上产生双链切口,松弛DNA超螺旋,进而解决DNA的拓扑结构问题。拓扑异构酶功能的重要性,使其成为多种抗肿瘤化疗药物和抗菌药物的有效靶标。目前,人们对拓扑异构酶的认识和理解主要来自于对真核生物以及细菌来源的拓扑异构酶的研究,而对于病毒编码的拓扑异构酶的结构和作用机制知之甚少。
非洲猪瘟病毒 (ASFV) 是一种高传染性的双链DNA病毒,可导致非洲猪瘟,感染后发病率和病死率可高达100%,目前尚无针对该病毒感染安全有效的商用疫苗和治疗药物。非洲猪瘟病毒编码的Ⅱ型拓扑异构酶P1192R在不同ASFV毒株中高度保守,且在病毒基因组复制过程中起着关键作用,是一个潜在的抗非洲猪瘟病毒药物靶标。
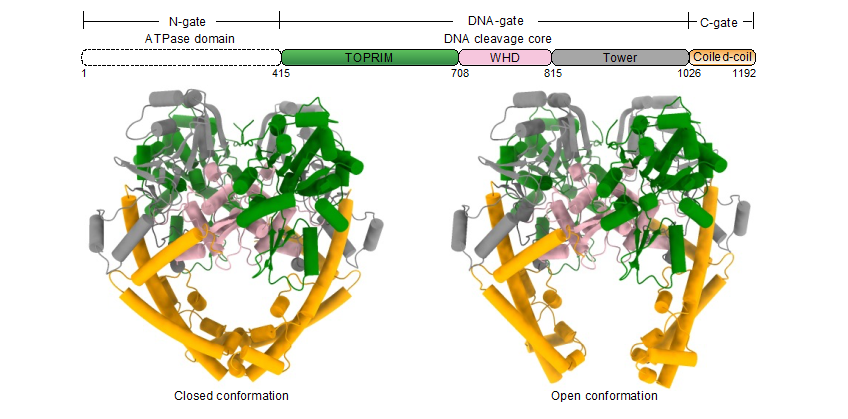
研究团队解析了两种不同功能状态下的P1192R冷冻电镜结构(图1)。尽管P1192R和已报道的其他真核和原核生物II型拓扑异构酶的氨基酸序列同源性较低,但是其整体的三维结构具有较高的相似性,即都形成同源二聚体,且每个单体主要由三个功能区域组成,分别是位于N末端的ATPase结构域、中间区的DNA切割核心区以及C末端的Coiled-coil结构域。值得注意的是解析的两种不同状态下的P1192R结构的主要差异来源于C末端的Coiled-coil结构域,其分别处于关闭和打开两种构象。这是首次在无DNA底物的情况下发现该区域呈现两种不同的状态,暗示Ⅱ型拓扑异构酶的Coiled-coil结构域可自发地打开或关闭。
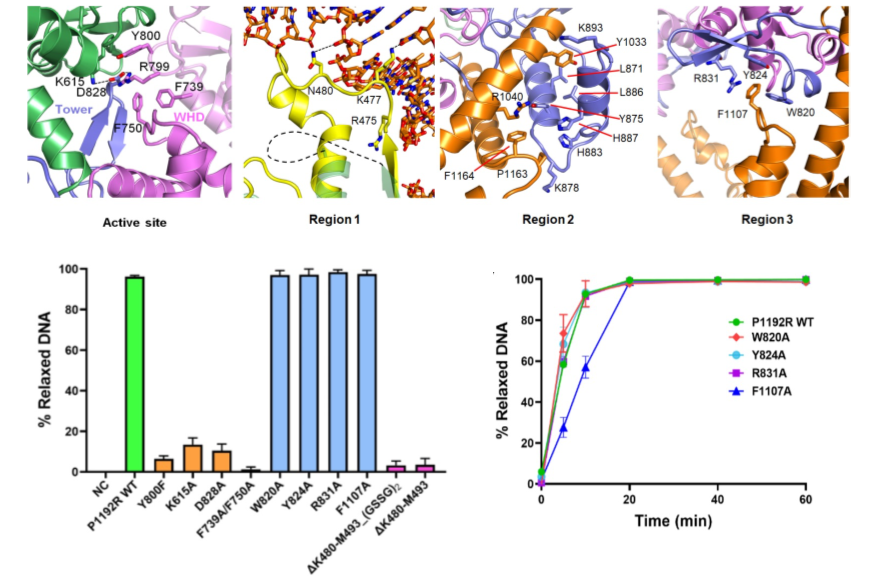
虽然ASFV P1192R相对于其他II型拓扑异构酶整体结构相似,但P1192R具有一些独特的结构特征(图2),包括:活性位点两对保守的离子键和一对疏水相互作用、TOPRIM结构域中一段柔性的loop(Region 1)、Tower结构域中一段额外插入的α-螺旋(Region 2)以及Coiled-coli结构域中的“别针样”结构(Region 3)。体外生化实验表明P1192R中参与活性位点相互作用的氨基酸突变和Region 1的缺失,均会显著降低P1192R的拓扑异构酶活性;Region 2的缺失很可能影响P1192R的结构完整性,进而导致蛋白折叠异常;而Region 3关键疏水氨基酸的突变则会降低P1192R在反应初始阶段的效率。以上结果表明P1192R的特异性结构对于其拓扑异构酶活性的维持或结构完整性非常重要。综上,该项研究促进了人们对于病毒拓扑异构酶的结构和功能的理解,为靶向病毒拓扑异构酶的抗非洲猪瘟药物的研发提供了重要依据。
武汉病毒所博士研究生赵艳与助理研究员匡文华为该论文的共同第一作者,邓增钦研究员和匡文华助理研究员为共同通讯作者。该研究获得了武汉市知识创新计划基础研究项目和中国科学院率先行动引才计划的经费支持。

 科技服务
科技服务