科研进展
鱼类病毒病的发生给我国水产养殖造成巨大的经济损失,鱼类病毒病的防控是我国水产养殖业亟待解决的重大难题。阐明鱼类抗病毒免疫反应的调控机制,筛选与鉴定调控鱼类抗病毒免疫反应相关的基因,可为鱼类抗病新品种的培育提供获选分子靶标。
抗病毒天然免疫应答是机体抵御病毒入侵的第一道防线。当RNA病毒侵染宿主后,位于线粒体中的关键接头蛋白MAVS会被上游传导的信号激活,发生多聚化,介导下游信号分子的激活,诱导干扰素等抗病毒基因的表达,从而在宿主抵御RNA病毒感染时发挥关键作用。为了能快速响应病毒入侵而被激活,并防止其过度激活而对机体造成免疫损伤,MAVS蛋白的活性需要被精确地调控。
 MAVS蛋白活性调节的“油门”和“刹车”模型
MAVS蛋白活性调节的“油门”和“刹车”模型
中国科学院水生生物研究所肖武汉研究员团队前期利用多组学技术,筛选到一系列调控鱼类抗病毒天然免疫反应的重要因子,其中包括去琥珀酰化酶SIRT5。他们发现:SIRT5可以通过去除MAVS蛋白的琥珀酰化修饰,抑制干扰素等抗病毒基因的表达;sirt5缺失的斑马鱼在生长、发育和繁殖等方面与野生型斑马鱼相比无明显差异,但是其抗RNA病毒感染的能力显著增强(Liu et al.,EMBO Journal,2020;Chen et al.,Journal of Immunology,2022)。
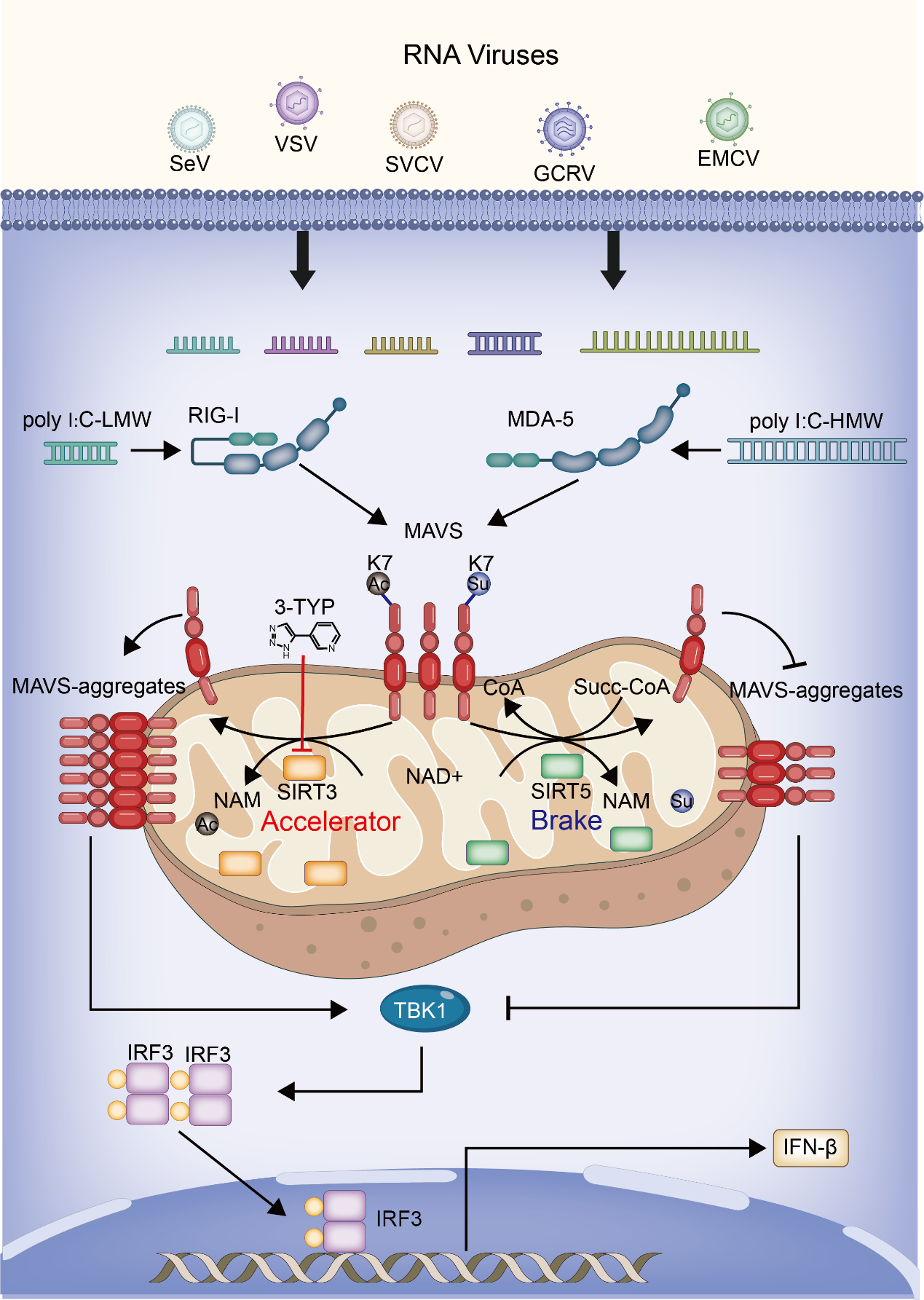 SIRT3和SIRT5调控MAVS蛋白活性的作用机制
SIRT3和SIRT5调控MAVS蛋白活性的作用机制
在此基础上,他们进一步发现,MAVS蛋白不仅存在琥珀酰化修饰,还存在乙酰化修饰,并且琥珀酰化修饰和乙酰化修饰发生在MAVS蛋白的同一个位点(第7位赖氨酸)。同属于Sirtuin蛋白家族的另一个成员SIRT3可以去除MAVS蛋白的乙酰化修饰,增强MAVS蛋白的多聚化和对下游信号通路的激活,从而诱导干扰素等抗病毒基因的表达,进而增强机体抵御RNA病毒感染的能力。在体实验表明:sirt3敲除的斑马鱼其抵御草鱼呼肠孤病毒(GCRV)和鲤春病毒血症病毒(SVCV)感染的能力显著降低。他们进一步利用小鼠模型证实了SIRT3的这一调控机制在脊椎动物中的功能保守性。当同时敲除Sirt3和Sirt5后,体内抗病毒基因的表达水平、机体的抗病毒能力恢复到野生型同样的水平。基于此,他们提出了MAVS蛋白活性调节的一个“油门”和“刹车”作用模型:SIRT3通过去除MAVS蛋白的乙酰化修饰,激活MAVS,起到了“油门”的作用;而SIRT5通过去除MAVS蛋白的琥珀酰化修饰,抑制MAVS活性,起到了“刹车”的作用。SIRT3和SIRT5介导的两种去酰基化修饰相互协调、相互制约,在RNA病毒感染机体时,既可以快速响应,激活抗病毒天然免疫反应,又可以避免机体天然免疫反应的过度激活而对机体造成损伤。
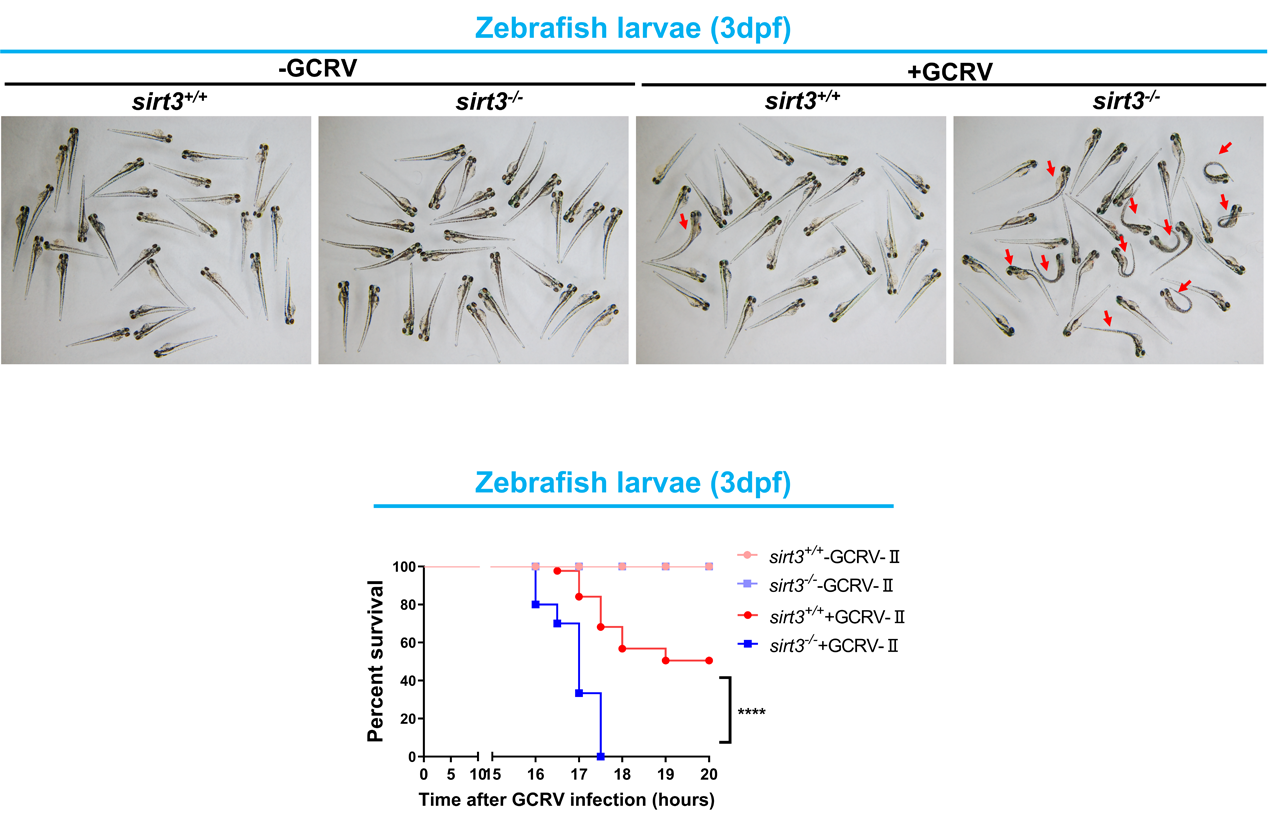
敲除sirt3显著降低斑马鱼抗草鱼呼肠孤病毒感染的能力
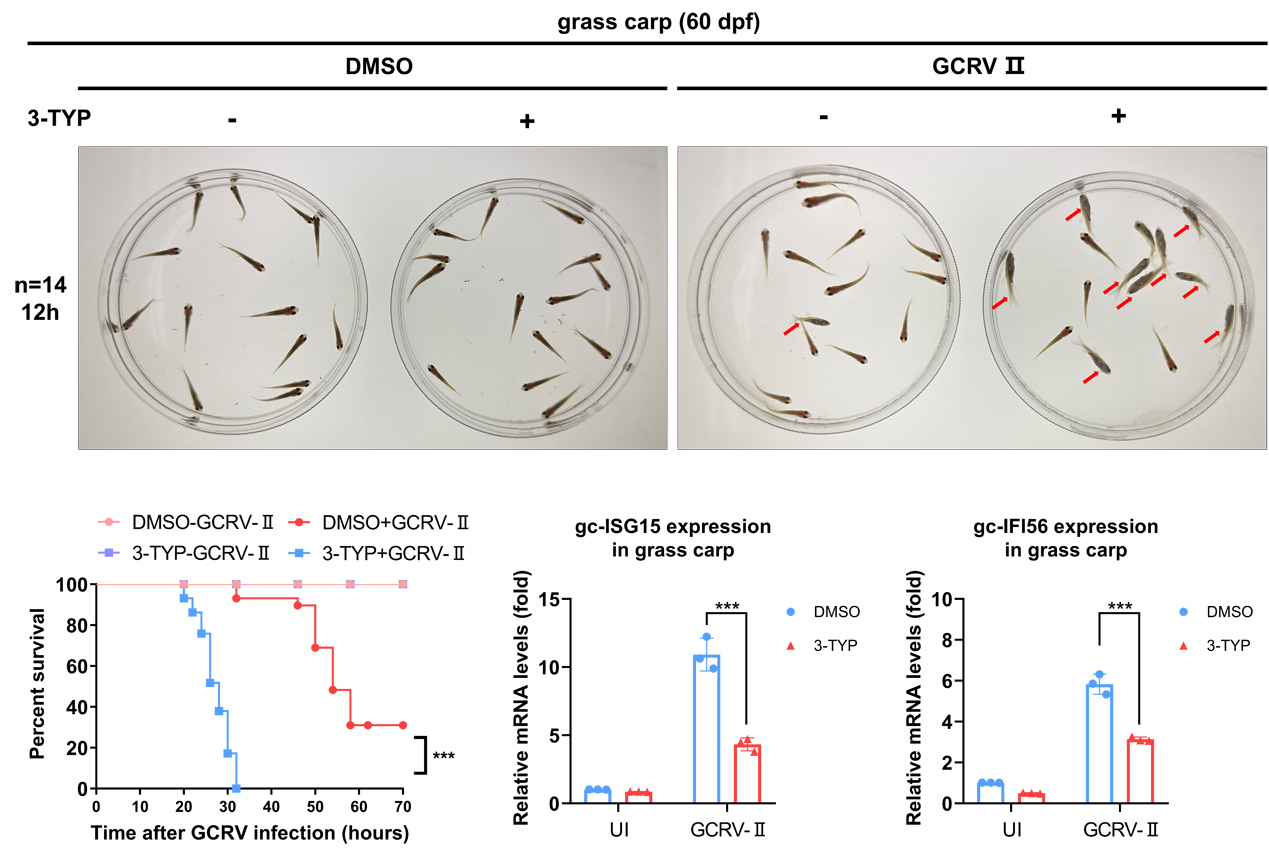
抑制草鱼sirt3的活性显著降低草鱼抗草鱼呼肠孤病毒感染的能力
4月 18 日,肖武汉团队在《美国科学院院刊》(PNAS)上,在线发表了题为“Dual modifying of MAVS at lysine 7 by SIRT3-catalyzed deacetylation and SIRT5-catalyzed desuccinylation orchestrates antiviral innate immunity”的研究论文,刘兴副研究员和朱纯纯特别研究助理为论文的共同第一作者,肖武汉研究员为通讯作者,课题组其他成员和水生所曾晓丽青年研究员为本研究提供了重要支持。该研究得到了中国科学院战略性先导专项B和专项A、国家自然科学基金、国家重点研发计划、湖北省自然科学基金杰出青年基金、农业生物育种2030等项目的资助。
此外,该团队还以草鱼为研究对象,进一步阐释了SIRT3在草鱼抵御草鱼呼肠孤病毒感染中的重要作用。他们发现:抑制SIRT3的活性将同样显著降低草鱼抗草鱼呼肠孤病毒感染的能力,这为培育草鱼抗呼肠孤病毒感染新品种提供了重要的分子标记。近日,相关的研究工作发表在Aquaculture上,朱纯纯特别研究助理为该文第一作者,肖武汉研究员和刘兴副研究员为共同通讯作者。
文章链接:
PNAS论文: https://www.pnas.org/doi/10.1073/pnas.2314201121
Aquaculture论文:https://doi.org/10.1016/j.aquaculture.2024.740871

 新闻
新闻